5月6号美国疾控中心发布了来自中国的KN95口罩抽样检查结果,其中发现了大量的低质量产品,FDA随即于5月7日撤回了中国60多家制造商向美国出口N95型口罩的紧急使用授权(EUA)。

美国食品和药物管理局周四表示,已将批准在美国使用的中国生产的KN95型口罩的制造商数量从约80个减少到14个。这推翻了 FDA 于 4 月 3 日关于“在中国生产的未经 NIOSH 批准的一次性过滤式口罩呼吸器”紧急使用授权中的决定,该 EUA 允许从中国口罩制造商那里进口未经 NIOSH 测试,但已通过独立实验室审查的口罩,口罩商只要能证明其符合美国疾控中心的标准,标准要求过滤95% 的 0.3 微米或更大的颗粒。
下面先让我们看下哪些厂家还在榜上:
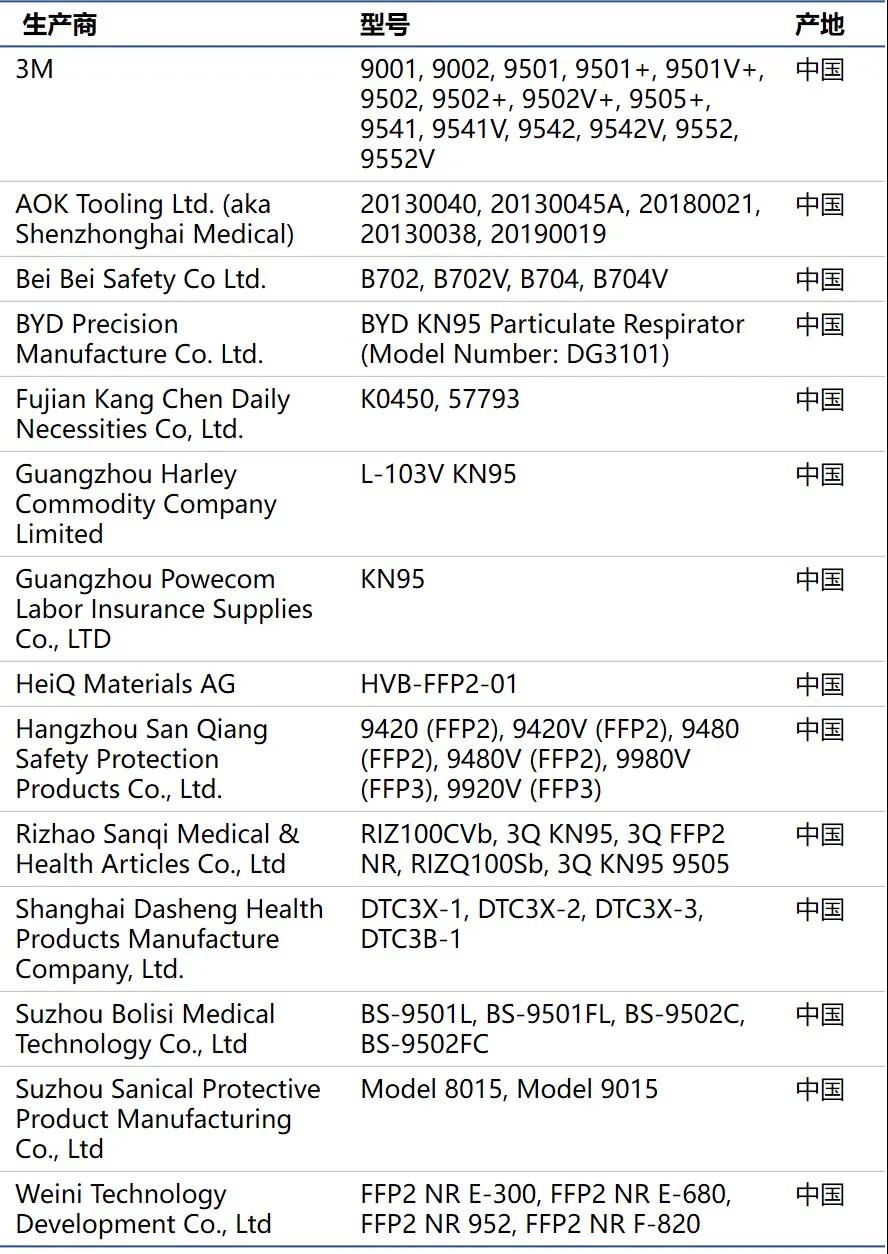
首先我们恭喜还留在榜单上的厂家,你们的产品质量绝对是一流的,经住了FDA+CDC的双重考验。为何FDA会突然删掉了一系列的厂家呢,这件事情甚至引发了华尔街日报对其的探讨,并且指出FDA撤回EUA授权主要是因为很多厂家质量并没有达到N95的标准。
为解决对不合格产品的质疑和担忧,美国 FDA 对其于 2020 年 4 月 3 日发布的旨在针对中国生产非 NIOSH 授权呼吸器的 EUA(紧急临时授权)(附录 A)的符合性准则做了修订,并为目前已存在于附录A,但即将被删除制造商提供了一个解决方案。修订后的 EUA(紧急临时授权)自2020 年 5月 7 日起生效。
颁发授权的新准则
中国生产的符合以下准则之一的一次性非NIOSH批准的呼吸器,符合5月7日修订的EUA授权:
1:呼吸器由持有一个或多个 NIOSH 批准的其他 FFRs型号的实体制造,这些型号是按照FDA 可验证的其他国家/地区适用的授权标准生产的;
2:通过了其他国家的认证,包括中国国家医药产品管理局(NMPA)注册认证,并且可以提供相应的能经FDA验证的证据;
3:对于曾经被添加到基于2020年4月3日授权的附录A 的呼吸器,需要在此修订版本 EUA 发布之日起45 日内提交 NIOSH 按照其修订版的标准测试规程(STP) TEBAPR‐STP‐0059 的评估,即最小最大过滤率均等于或大于95%。
符合如上任何一项新授权准则的呼吸器在 FDA 确认相关资质文件符合要求后会作为授权呼吸器添加到附录 A中。
针对已经通过浙江顶峰技术服务有限公司申请EUA但未获授权的客户,现特通知如下:
A:如果贵司的呼吸器产品符合如上描述的1项、2项新授权准则,请通知我们。我们在收到相关证明文件后会重新向 FDA 提交新的申请,且不再收取任何额外的费用。
B: 如果贵司的呼吸器产品不符合如上 1 项或 2 项描述的新授权准则,但希望申请 NIOSH 的评估,我们将贵司申请 EUA 的费用抵扣申请 NIOSH评估的部分费用。
C: 如果贵司决定对如上 A 和 B方案都不采纳,我们将全额退还已经支付的费用。
往期回顾:
下期预告:
KN95口罩申请NIOSH认证费用知多少?
中文:许小平 (含常规FDA注册,列名)
电话:0571-28932898
邮件:Kelvin.Xu@zics.cn
英文:Basil Shamsid-Deen(EUA申请)
电话:0571-26262861
邮件:Baisl.Deen@zics.cn

